지난 포스팅에서는, 임상시험실시기관(Site)를 선정하는 절차에 대해 알아보았습니다.
의뢰자(Sponsor)로부터 Site가 승인되어 임상시험에 참여할 연구기관으로 선정되었다고 해서 임상시험을 시작할 수 있는 것은 아닙니다. 해당 Site가 임상시험에 참여하기 위해서는 IRB의 승인을 받아야 합니다.
이번 포스팅에서는 IRB와 IRB 승인 절차에 대해 알아보겠습니다.

IRB란?
IRB는 Institutional Review Board의 약어로, 인간을 대상으로 하는 모든 연구의 윤리적, 과학적 측면을 검토하여, 임상연구에 참여하는 대상자의 복지, 안전, 권리를 보호하기 위한 독립된 기구입니다. 생명윤리위원회라고도 하지만, 대부분 IRB라는 약어를 사용합니다.
IRB의 대표적인 권한
IRB는 임상시험 연구를 심의하기 위해 다음과 같은 권한들을 가집니다.
1) IRB는 심의 요청된 연구의 연구계획서의 윤리적, 과학적 타당성, 연구대상자 동의서 수집 절차, 연구대상자의 안전 및 개인정보에 관한 사항 및 그 밖에 생명, 윤리, 안전에 관해 필요한 사항들을 심의한다.
2) IRB는 연구계획서 검토를 위해 추가적인 정보 제공을 요구할 수 있다.
또한, IRB는 이미 심의를 완료하여 임상시험이 진행중인 연구에 대해서도 다음과 같은 권한들을 가집니다.
1) IRB는 필요한 경우 수행중인 임상시험 연구의 과정 및 결과에 대하여 조사, 감독한다.
2) IRB는 해당 연구의 연구대상자에게 미치는 위험에 따라 연구책임자에게 적절한 주기로 보고받고 이를 지속심의한다.
3) IRB는 진행중인 연구에 대해서 중대한 위험 또는 위반 등 생명, 윤리, 안전에 관해 중대한 위협이 있다고 판단되는 경우, 심의를 거쳐 해당 연구를 제한, 중지, 보류할 수 있다.
IRB 심의신청 제출서류
대표적으로 IRB 심의 신청을 위해서는 아래와 같은 서류들이 필요합니다.
1) 연구계획심의 신청서
2) 연구계획서(Protocol)
3) 연구대상자 동의서(ICF)
4) 연구대상자로부터 연구를 위해 얻어지는 정보 (증례기록서(CRF), 설문지, 복용일지 등)
5) 연구대상자에게 제공되는 서류
6) 연구대상자 모집 관련 문서
7) 연구비 관련 서류
8) 연구책임자(PI) 이력 및 생명윤리준수서약서
IRB 심의 종류
대표적으로 IRB는 정규심의, 신속심의가 있으며, 심의면제인 경우도 있습니다.
제출하려는 심의가 어느 종류에 해당하는 지는 각 IRB에 따라 다를 수 있으므로, 확인 후 진행하시면 됩니다.
- 정규심의 : 정해진 일정에 따라 정해진 인원 수의 위원이 참여하여 심의함. 일정은 IRB마다 상이함.
- 신속심의 : 1인 이상/최소한의 인원에게 심의권한을 위임하여 신속하게 심의함
IRB 심의 절차
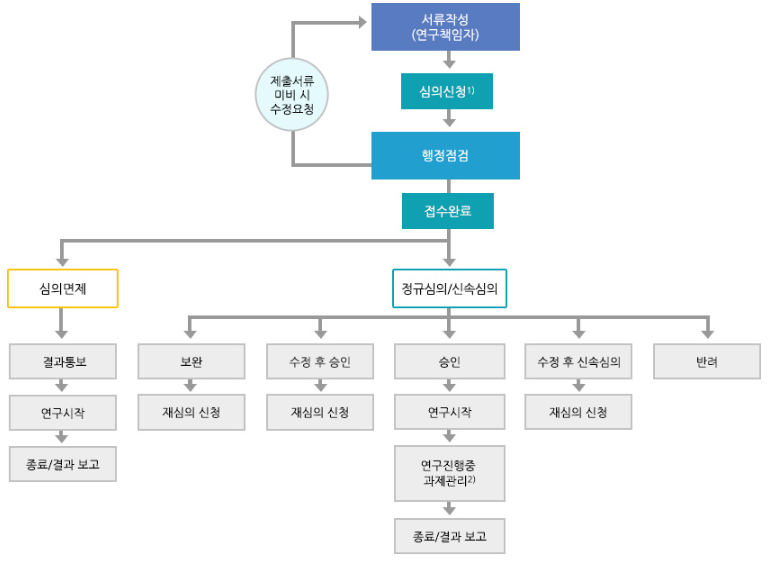
IRB 심의료
IRB 심의료는 기관마다 다르지만,
1) 연구의 속성(의뢰자 주도 위탁 연구 vs 연구자 주도 학술 연구)에 따라 다릅니다.
2) 초기심의 vs 재심의 vs 지속심의 인지에 따라 다릅니다.
IRB 종류
국내에는 임상시험 실시기관마다 자체적으로 IRB를 구성하여 운영하는 경우가 많은데요, 해외의 일부 국가의 경우 Local IRB vs Central IRB로 나뉘는 경우가 많습니다.
Local IRB는 국내와 같이 임상시험 실시기관에서 자체적으로 운영하는 IRB이며, Central IRB는 특정 임상시험 실시기관에 속하지 않고, 여러 임상시험 실시기관에 IRB 서비스를 제공합니다.
임상시험 실시기관의 규모 및 절차에 따라서 자체적인 Local IRB만을 사용하는 경우가 있고, Local IRB와 Central IRB를 같이 사용하는 경우가 있으며, Local IRB 없이 Central IRB를 사용하는 경우도 있습니다.
Local IRB와 Central IRB를 같이 사용하는 임상시험실시기관의 경우, 대부분 문서를 Central IRB를 통해 제출하지만, 기관의 정책에 따라 일부 Local IRB에도 제출하여야 하는 경우도 있습니다.
미국은 특히 Central IRB를 사용하는 임상시험 실시기관이 많으며, 대표적으로 Advarra가 Central IRB의 역할을 합니다.
Advarra는 아래 홈페이지에서도 살펴볼 수 있듯이, IRB 이외에도 다른 서비스(IBC, DMC, EAC)도 제공합니다.
https://www.advarra.com/review-services/institutional-review-board/
Institutional Review Board Services | Advarra IRB Services
Solutions to safeguard trial participants regardless of project scope, therapeutic niche, or number of investigators.
www.advarra.com
국내에서는 Central IRB의 개념이 도입된 지 얼마 되지 않았는데요, Covid 팬대믹의 영향으로 수많은 제약회사에서 Covid-19 관련 연구를 진행하기 위해 IRB 심의를 신청하였기 때문에, 이러한 긴급한 상황에 원활하게 대처하기 위하여, 공용IRB가 출범되었습니다.
기관생명윤리위원회 정보포털
기관생명윤리위원회 이용자별 맞춤 정보에 오신 것을 환영합니다. 이용자별 정보를 한눈에 보실 수 있습니다. 인간대상연구자 인체 유래물 연구자 배아생성의료기관 종사자 배아등 연구자 배
irb.or.kr
*공용IRB, 공용기관생명윤리위원회란?
생명윤리 및 안전에 관한 법률에 따라, 보건복지부장관이 기관 또는 연구자가 공동으로 이용할 수 있도록 지정한 위원회입니다. 공용IRB는 접수된 IRB 심의에 대해 신속하게 검토하여, Covid-19 관련 임상연구의 윤리적이고 안전한 연구 수행 및 관리를 지원하고자 하는 목적을 가지고 있습니다.
'임상 Overview' 카테고리의 다른 글
| CRO/제약회사의 조직 구조 (0) | 2022.08.31 |
|---|---|
| 임상시험 : SIV(Site Initiation Visit)에 관하여 (0) | 2022.08.30 |
| 임상시험 : 임상시험실시기관 선정(Site selection) 절차 (2/2) (0) | 2022.08.22 |
| 임상시험 : 임상시험실시기관 선정(Site selection) 절차 (1/2) (0) | 2022.08.18 |
| 임상시험 : CRF 개발에 대하여 (0) | 2022.08.17 |




댓글