이번 포스팅에서는, 임상시험을 시작하기에 앞서 준비해야 할 부분 중, 임상시험계획서 작성에 대하여 알아보겠습니다.

임상시험계획서(Protocol, PT/PRT)
임상시험계획서는 줄여서 PT 혹은 PRT라고 부르기도 합니다. 임상시험계획서의 독자인 연구자와 규제당국에 해당 임상시험의 배경이나 근거를 제공하기 위해, 임상시험의 목적, 연구방법론, 통계학적 측면, 안전성 측면, 윤리적 측면 등 다양한 부분이 기술된 문서를 말합니다. 임상시험계획서는 임상시험 시작 전에 작성되며, 규제기관의 승인을 받아야 합니다.
임상시험계획서는 주로 Medical Writer가 작성하지만, 임상시험 단계 및 경우에 따라서 연구자가 작성하는 경우도 있습니다.
Medical Writer 및 임상관련 직무에 대해 궁금하시다면, 이전 포스팅을 참고 부탁드립니다.
임상관련 직무에 대해 알아보기
안녕하세요. 제약회사 및 바이오회사, CRO(임상시험 수탁기관) 등에 취직을 희망하시는 분들을 위해 간단히 제가 경험하고 느낀 직무들에 대한 특징을 정리해보았습니다. 전공에 따라 선택할 수
clinicaltrials-info.com
임상시험계획승인신청(Investigational New Drug Application, IND)
앞서 말했듯이, 임상시험계획서는 사전에 규제기관의 승인을 받아야 하는데, 이러한 승인절차가 바로 IND입니다. IND는 인체를 대상으로 한 안전성 및 유효성 자료 수집을 목적으로 해당 의약품을 사용하여 임상시험을 실시하려는 자가 규제기관의 승인을 신청하는 절차입니다. 규제기관에서는 임상시험계획서가 올바르게 작성되었는 지 검토한 후, 올바르게 작성되었다면, IND를 승인하여 임상시험이 시작될 수 있도록 합니다.
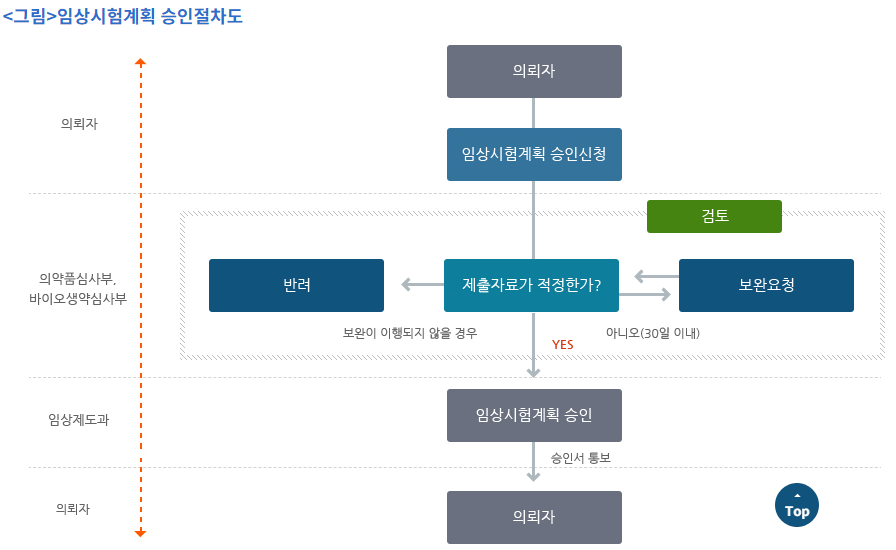
Protocol 작성 시, 포함되어야 하는 내용
임상시험을 승인받기 위해서는, 임상시험계획서를 올바르게 작성하는 것이 중요합니다. ICH guideline - Efficacy Guideline(E) - Good Clinical Practice (E6_R2)에 따라, 임상시험계획서에는 일반적으로 다음과 같은 내용을 포함하여야 합니다.
6.1 General Information (일반 정보)
6.2 Background Information (배경 정보)
6.3 Trial Objectives and Purpose (시험의 목표와 목적)
6.4 Trial Design (시험 설계)
6.5 Selection and Withdrawal of Subjects (시험대상자의 선정과 탈락)
6.6 Treatment of Subjects (시험대상자 치료)
6.7 Assessment of Efficacy (유효성 평가)
6.8 Assessment of Safety (안전성 평가)
6.9 Statistics (통계)
6.10 Direct Access to Source Data/Documents (근거자료/문서의 직접열람)
6.11 Quality Control and Quality Assurance (품질 관리 및 품질 보증)
6.12 Ethics (윤리)
6.13 Data Handling and Record Keeping (자료 처리 및 기록 보관)
6.14 Financing and Insurance (재정 및 보험)
6.15 Publication Policy (자료 발표 방침)
6.16 Supplements (보충)
ICH Guideline을 읽어보면, 대략적으로 어떠한 세부 내용들이 임상시험계획서에 기재되어야 하는 지 알 수 있지만, 세부적으로 이해하기는 어렵습니다. 세부적으로 이해하기 위한 가장 좋은 방법은 작성된 여러 임상시험계획서를 참고하는 것입니다.
Protocol 작성 시 참고할 만한 웹사이트
1. Clinicaltrials.gov
Home - ClinicalTrials.gov
Country United States Afghanistan Albania Algeria American Samoa Andorra Angola Antigua and Barbuda Argentina Armenia Aruba Australia Austria Azerbaijan Bahamas Bahrain Bangladesh Barbados Belarus Belgium Belize Benin Bermuda Bhutan Bolivia Bosnia and Herz
clinicaltrials.gov
이 사이트는 웹 기반 Database로, 환자, 가족, 의료 전문가, 연구원 및 일반 대중들이 임상 연구에 대한 정보를 얻을 수 있는 사이트입니다. 미국 국립 보건원(National Institutes of Health, NIH)에서 관리하며, 미국에서 수행된 임상연구 뿐만 아니라, 다른 국가에서 실시되는 임상연구 또한 등록되어 있습니다. 법에 따라 모든 연구를 등록해야 하는 것은 아니지만, 해당 사이트에 임상시험 등록을 요구하는 정책 및 법률이 제정됨에 따라, 대부분의 임상연구가 해당 사이트에 등록되어 있다고 해도 과언이 아닙니다.

ClinicalTrials.gov 홈페이지에 접속하게 되면, 가장 먼저 위와 같은 화면을 볼 수 있습니다. 조건에 따라 원하는 임상시험 정보를 검색할 수 있는데, 이때 하단의 Search 버튼 옆의 Advanced Search를 클릭하면, 더욱 조건을 세분화하여 검색할 수 있습니다.
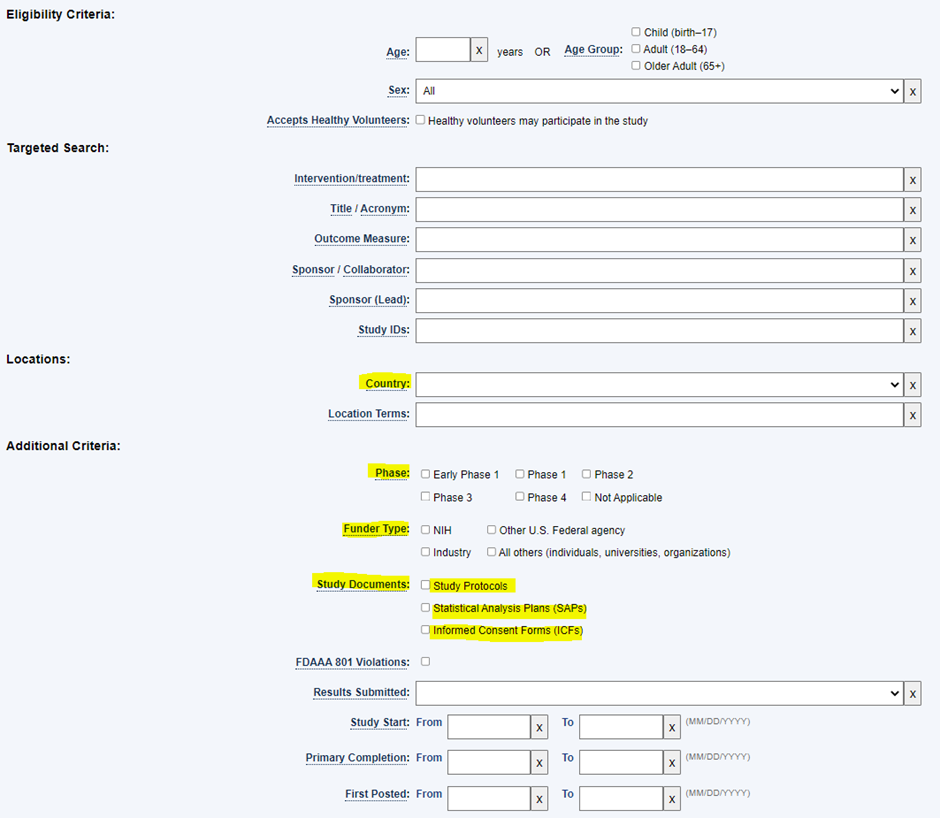
위와 같이, 선정제외기준(연령, 성별), 임상시험 실시 국가, 임상시험 단계, 자금의 출처 등을 조건으로 검색할 수 있습니다.
뿐만 아니라, Study Documents 조건을 통해, Study Protocol이 있는 임상시험 연구를 검색할 수도 있습니다.
저는 아래와 같은 조건의 임상시험을 검색해 보았습니다.
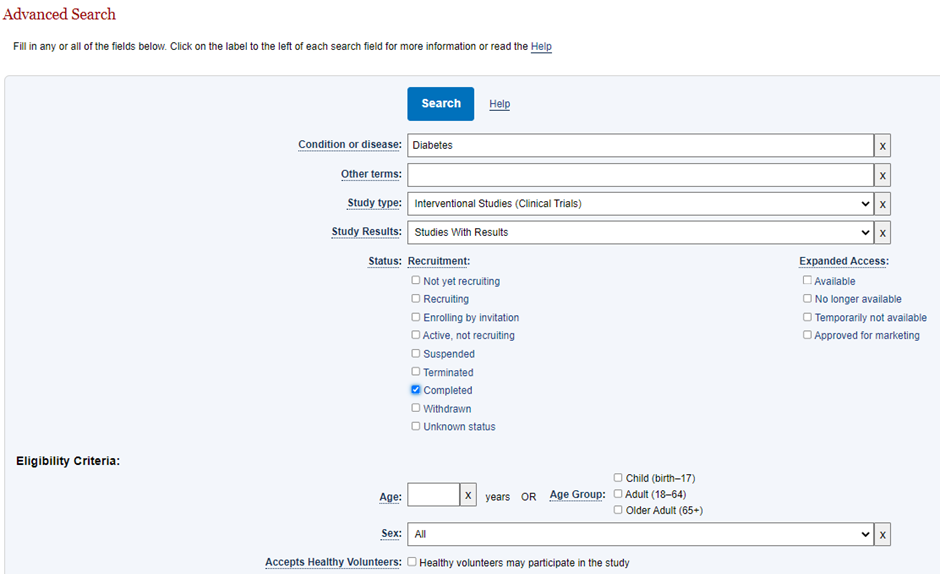
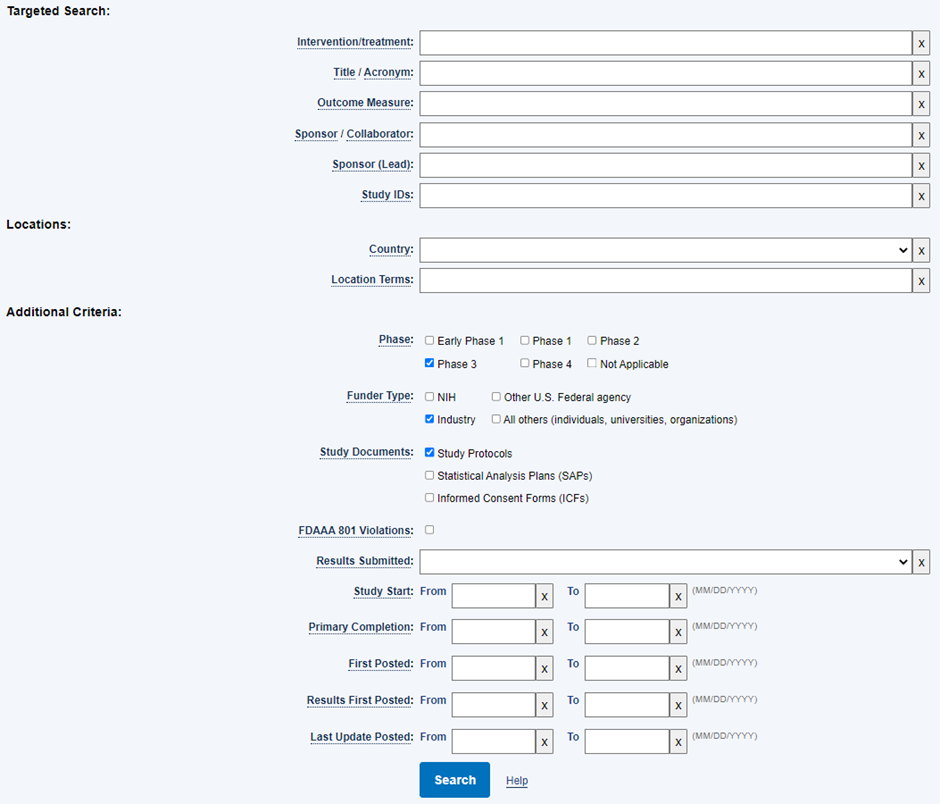
검색 결과, 총 143건의 임상시험이 검색되었으며, 그 중 가장 첫 번째의 임상시험을 살펴보겠습니다.

Study Details, Tabular View, Study Results로 나뉘어져 있고, Protocol은 Study Details 페이지 하단의 링크를 클릭하면 다운받을 수 있습니다.


2. FDA - Approved Drugs
https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm
Drugs@FDA: FDA-Approved Drugs
www.accessdata.fda.gov
위의 링크로 접속하면, FDA에서 승인된 약물을 검색할 수 있습니다.
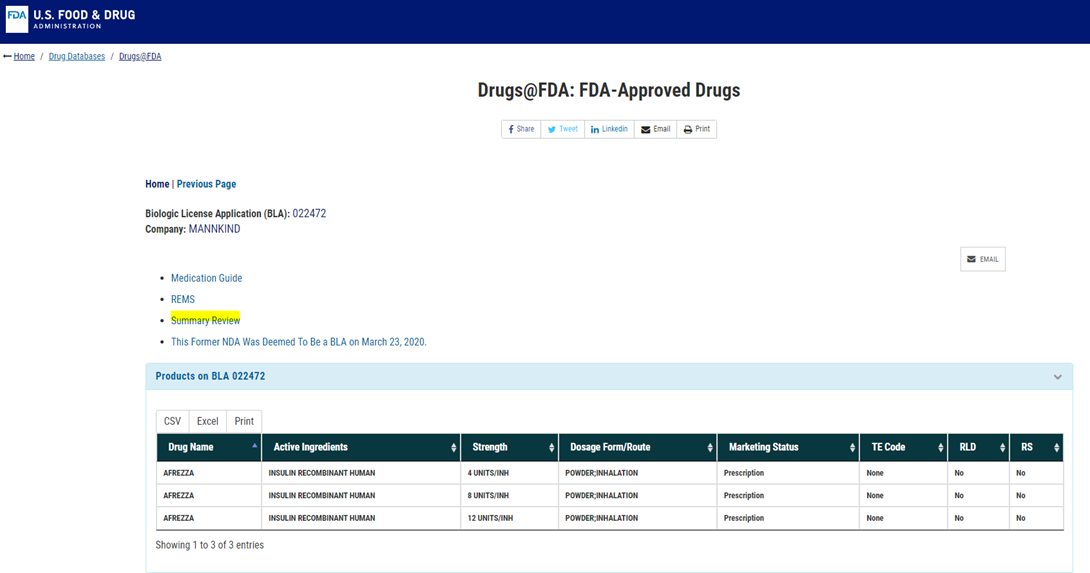
Afrezza를 검색해본 결과, 위와 같이 승인된 약물 정보가 뜨고, 그 위에 Summary Review 파일이 링크되어 있음을 알 수 있습니다. 이는 FDA에서 승인을 위해, Review한 내용에 대한 summary이며, Introduction, Background, 비임상시험자료, 임상시험자료, 안전성에 대한 부분 및 기타 임상시험 관련된 부분에 대해 전반적으로 검토된 내용을 볼 수 있습니다. 이러한 Summary Review를 통해, 규제기관에서 중요시하는 부분을 알 수 있고, 어떠한 부분에 대해 우려가 있었는 지를 확인할 수 있습니다.
작성하려는 임상시험의 Indication에 따라, 관련된 의약품의 Summary Review 자료를 개발 단계에서 미리 검토한다면, 도움이 될 것이라 생각합니다.
3. Clinical e-Protocol Writing Tool
https://e-protocol.od.nih.gov/
OSP e-Clinical Portal
e-protocol.od.nih.gov
보통 임상시험계획서를 개발하는 의뢰사의 경우, 회사내에 자체적인 Protocol Template이 있기 때문에, Template을 참고하여 작성하면 되지만, Template이 없을 경우, 이 사이트를 참고할 수 있습니다.
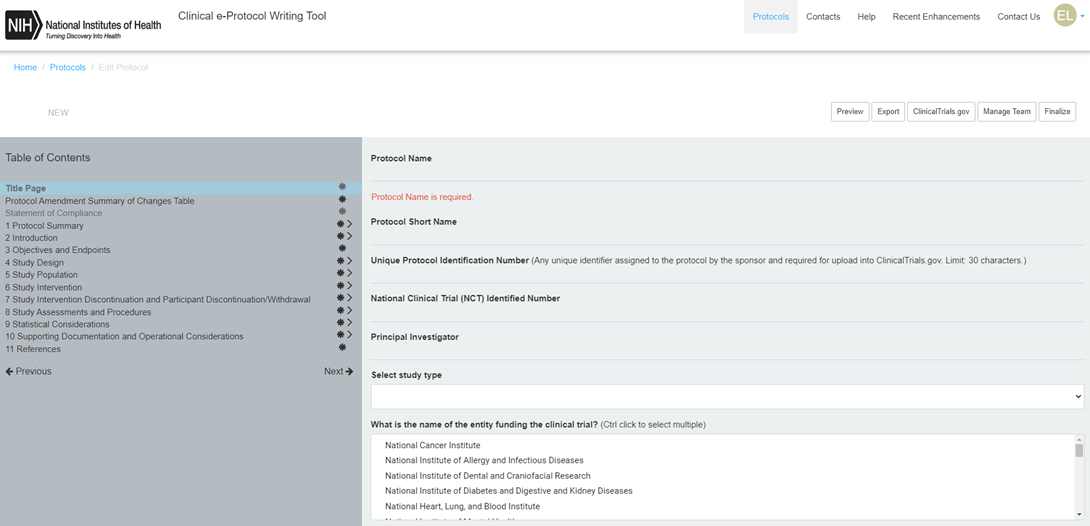
무료가입 후, 로그인을 하면, 아래 그림과 같이 New Protocol을 Create할 수 있습니다.

+Create New Protocol버튼을 클릭하면, 아래와 같이 왼쪽의 각 Contents를 클릭하여 기입할 수 있습니다.
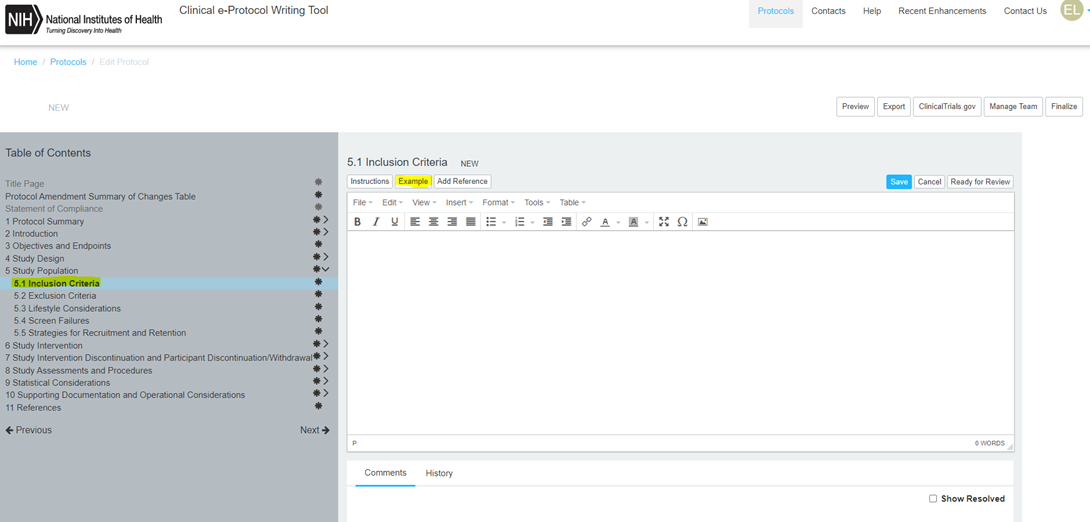
예를 들어, 5. Study Population의 5.1 Inclusion Criteria인 선정기준에 대한 부분을 작성할 경우, 아래와 같이, 상단의 Instructions, Example등을 참고할 수 있습니다.
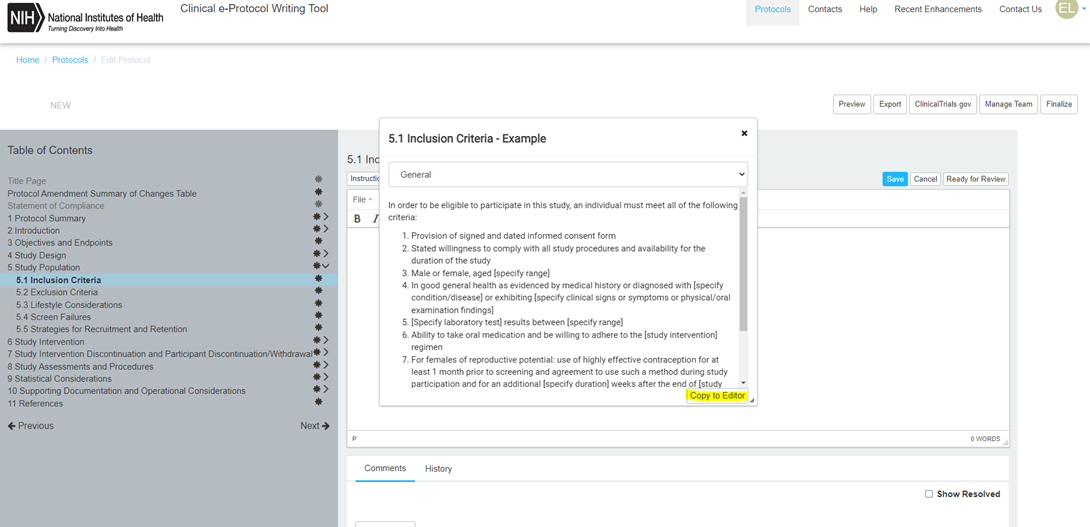
Example을 클릭할 경우, 아래와 같이 Example 예시가 나오며, 이를 Copy to Edit하면, 작성중인 Protocol 본문 중, 해당 section인 5.1에 해당 예시문구가 Paste되기 때문에, 적절히 수정하여 Protocol을 작성할 수 있습니다.
'임상 Overview' 카테고리의 다른 글
| 임상시험 : 임상시험실시기관 선정(Site selection) 절차 (1/2) (0) | 2022.08.18 |
|---|---|
| 임상시험 : CRF 개발에 대하여 (0) | 2022.08.17 |
| 약물감시(PV; pharmacovigilance) 직무란? (0) | 2022.01.24 |
| 내가 먹는 이 약, 무슨 약일까? 약 모양 검색하기 (0) | 2022.01.03 |
| 제약회사, CRO 취직/이직 정보 및 관련 교육 정보 (0) | 2021.12.29 |




댓글