PV(pharmacovigilance)란?
약물감시라고 하며, 현재 회사에서 수행하고 있는 임상시험뿐만 아니라, 회사에서 기 승인받은 의약품들의 부작용 및 이상사례를 수집, 탐지, 모니터링하는 직무이다. 궁극적으로 약물감시의 목표는 의약품과 관련된 이상사례 및 위험을 식별하고 위험을 최소화하는 데 있다. (Risk Management)
임상시험 안전성 관련 국내 규정은 다음과 같다.
약사법은 법령체계 중 최상위로, 그 밑으로 다음과 같이 세부 규칙 및 기준들이 있다.
법령체계 : 법(약사법) > 시행령(약사법 시행령) > 시행규칙(의약품 등의 안전에 관한 규칙) > 고시(신약 등의 재심사 기준) > 지침(고려사항/가이드라인)
PV 관련 용어 정의
PV업무에 대해 알아보기 위해서는, 관련 용어 정의를 숙지하는 것이 필요하다.
아래 정의들은 의약품 임상시험 관리기준(KGCP)에 따른다.
-이상반응(Adverse Event, AE) : 임상시험용 의약품을 투여한 시험대상자에게 발생한 모든 유해하고 의도하지 않은 증후(sign, 실험실 실험결과의 이상 등을 포함한다), 증상(symptom), 또는 질병을 말하며, 해당 임상시험용 의약품과 반드시 인과관계를 가져야 하는 것은 아니다.
-약물이상반응(Adverse Drug Reaction, ADR) : 임상시험용 의약품의 임의 용량에서 발생한 모든 유해하고 의도하지 않은 반응으로서 임상시험용 의약품과 인과관계를 부정할 수 없는 경우를 말한다.
-중대한 이상반응/약물이상반응(Serious AE/ADR) : 임상시험용 의약품의 임의용량에서 발생한 이상반응/약물이상반응 중에서 다음의 어느 하나에 해당하는 경우를 말한다.
1) 사망하거나 생명에 위험이 발생한 경우
2) 입원할 필요가 있거나 입원기간을 연장할 필요가 있는 경우
3) 영구적이거나 중대한 장애 및 기능 저하를 가져온 경우
4) 태아에게 기형 또는 이상이 발생한 경우
5) 그 외, 약물 의존성이나 남용의 발생 또는 혈액질환 등 그밖에 의학적으로 중요한 상황이 발생하는 사례
즉, AE 중에서 인과관계를 부정할 수 없는 경우 ADR로 분류된다. (AE ⊃ ADR)
또한, AE중에서 위의 1)~5)에 해당하는 경우 SAE로 분류되며, 이 중 인과관계를 부정할 수 없는 경우는 SADR로 분류할 수 있다. (AE ⊃ SAE ⊃ SADR)
-예상하지 못한 약물이상반응(Unexpected Adverse Drug Reaction) : 임상시험자 자료집 또는 의약품의 첨부문서 등 이용 가능한 의약품 관련 정보에 비추어 약물이상반응의 양상이나 위해의 정도에서 차이가 나는 것을 말한다.
임상시험/연구 종류에 따른 보고기한
| 임상시험/연구 | 보고 규정 |
|||
| 관련 법규 | 종류 | 보고기한 | 보고 | |
| 시판전 임상시험 (1상~3상) |
의약품등의 안전에 관한 규칙 별표4 KGCP | SUSARs | 7일(사망, 생명의 위협) 15일 (기타) |
식약처 임상제도과에 보고 |
| 시판후 임상시험 (4상) |
IND승인받은 경우, 의약품등의 안전에 관한 규칙 별표4 KGCP |
SUSARs | 7일(사망, 생명의 위협) 15일 (기타) |
|
| IND 승인받지 않은 경우, 의약품등의 안전에 관한 규칙 별표4의 3 KGVP |
SADRs | 15일 (신속보고) | 한국의약품안전관리원(KIDS)에 보고 | |
| Non-SADRs | 분기별 (결과보고서 제출 시점) | |||
| 시판후조사 (신약 등의 재심사) |
신약 등의 재심사기준 | SADRs | 15일 (신속보고) | |
| Non-SADRs | 정기보고서 제출 시점 | |||
| 비중재적/관찰 연구 | 의약품등의 안전에 관한 규칙 별표4의 3 KGVP | SADRs | 15일 (신속보고) | |
| Non-SADRs | 분기별 (결과보고서 제출 시점) | |||
위와 같이, 임상시험/연구의 종류 및, 이상사례의 종류에 따라 보고기한과 어디에 보고해야 하는지가 다릅니다. PV는 이러한 사항들을 잘 알아두어, 시기적절하게 보고하여야 합니다.
SUSAR (Suspected Unexpected Serious Adverse Reaction, 중대하고 예상하지 못한 약물이상반응)는 '쑤싸'라고 읽으며, 중대하고(Serious), 인과관계가 있고(Related), 예상하지 못한(Unexpected)인 이상반응을 일컫는다.
SUSAR는 신속보고 대상이기 때문에, SUSAR가 발생했을 경우, 시험자, 식약처, 필요 시 IRB에도 보고하여야 한다.
임상시험을 진행하다 보면, EDC에 이상반응(AE)가 수집되는데, 이때 수집된 AE가 SAE(Serious AE)라고 수집되면, SAE는 의뢰자 및 IRB에 신속 보고된다. 이렇게 보고된 SAE를 평가하여, 이 SAE가 SUSAR인 지 아닌 지 판단한다.
해당 SAE가 SUSAR로 판정될 경우, 위의 표의 보고기한 내에 보고하여야 한다.
그 외, 신속보고 기준 및 대상, 정기보고서, DSUR, IB 등에 대한 내용은 추후 자세히 다루겠다.
SUSAR 전자보고 방법
SUSAR를 전자보고 하는 방법은, 이전 포스팅에서 다뤘던 의약품안전나라 홈페이지에서 가능하다.
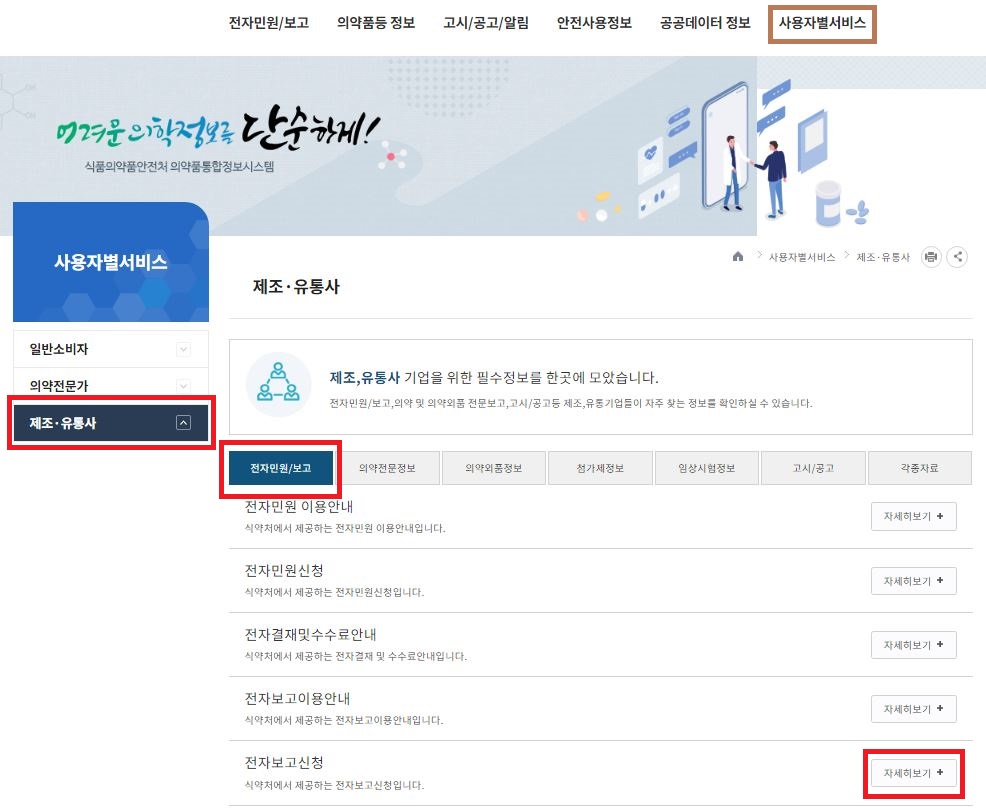
의약품 안전나라(https://nedrug.mfds.go.kr/index)에서, 우측 상단의 '사용자별서비스'를 클릭 > '제조 유통사' 클릭 > '전자민원보고' 메뉴 중 하단의 '전자보고신청' 의 자세히 보기의 서비스를 통해 전자보고가 가능하다.
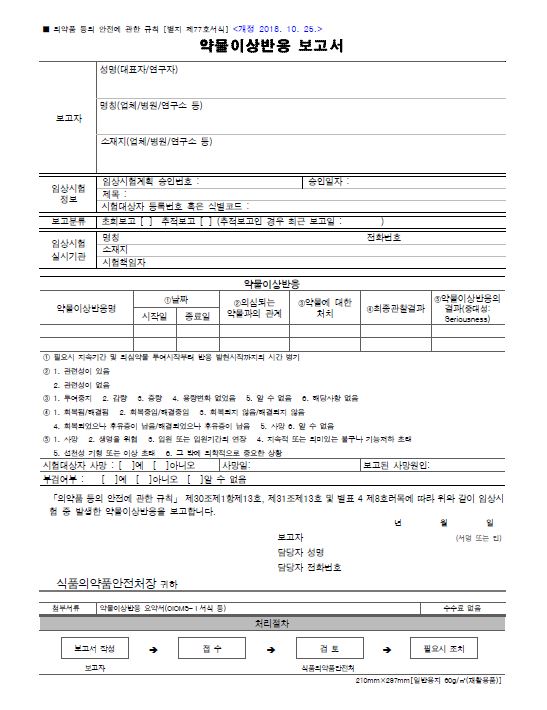
보고서 서식은 '별지 77호 서식' 또는 'CIOMS form' 을 통해 가능하다. 회사에서 Safety Database를 사용하는 경우, Safety Database를 사용하여 CIOMS form에 맞게 파일을 생성할 수 있고, 이를 바로 upload 하여 보고가 가능하다.
- 별지 77호 서식
- CIOMS[씨옴스] form
'임상 Overview' 카테고리의 다른 글
| 임상시험 : CRF 개발에 대하여 (0) | 2022.08.17 |
|---|---|
| 임상시험 : 임상시험계획서(Protocol) 작성에 대하여 (0) | 2022.08.16 |
| 내가 먹는 이 약, 무슨 약일까? 약 모양 검색하기 (0) | 2022.01.03 |
| 제약회사, CRO 취직/이직 정보 및 관련 교육 정보 (0) | 2021.12.29 |
| CRO(임상시험 수탁기관), local CRO, Global CRO, 오픈톡방 (0) | 2021.12.28 |





댓글